
Enlace iónico o covalente
El enlace químico es la fuerza que mantiene unidos a los átomos en una molécula. Dos tipos de enlaces predominan cpvalente la química: el enlace iónico y el enlace covalente. Ambos enlaces son fundamentales en la formación de compuestos químicos y tienen características y propiedades distintas.
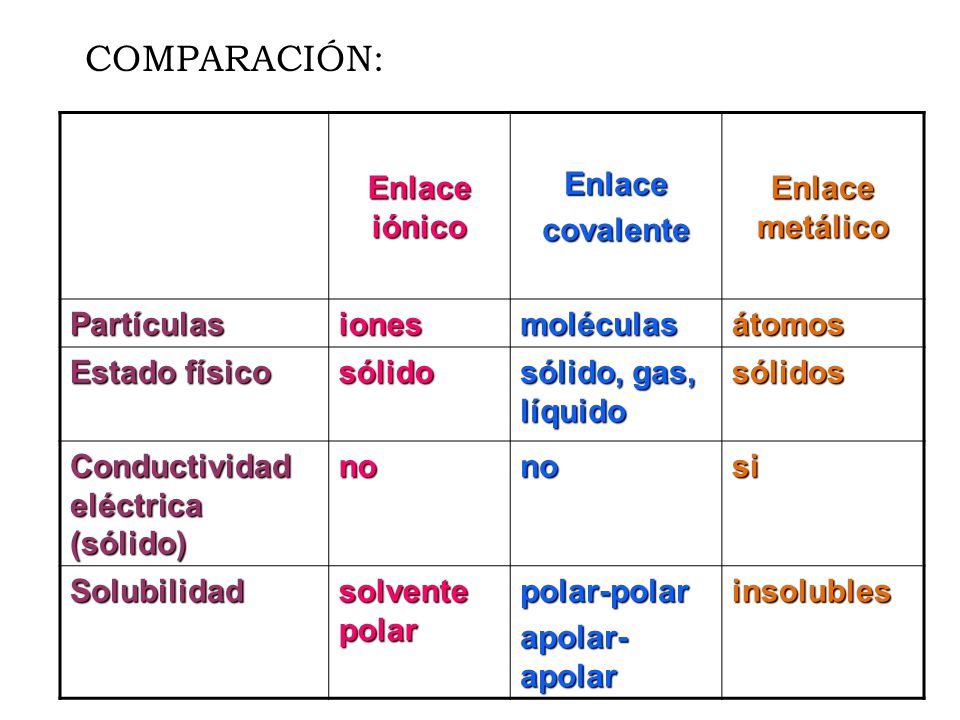
Enlace iónico
El enlace iónico se forma cuando un átomo cede electrones a otro átomo.

Esto ocurre cuando un átomo tiene baja energía de ionización y otro tiene alta afinidad electrónica. El Enlce que cede electrones se convierte en un catión positivo, mientras que el átomo que los acepta se convierte en un anión negativo. Estos iones se atraen eléctricamente y se mantienen unidos formando una estructura cristalina sólida.
El enlace iónico es típico en compuestos formados por metales y no metales.
Ejemplos comunes de compuestos iónicos incluyen el cloruro de sodio (NaCl) y el sulfato de calcio (CaSO4). Los compuestos iónicos son sólidos cristalinos en estado sólido y, cuando se disuelven en agua, se disocian en sus iones constituyentes, lo que les confiere alta conductividad eléctrica.
Enlace covalente
En contraste con el enlace iónico, el enlace covalente se forma cuando dos átomos comparten electrones para completar sus niveles de energía externos y alcanzar una mayor estabilidad.
Este tipo de enlace se encuentra comúnmente entre no metales y se divide en enlace covalente polar y no polar.
Cuando los átomos comparten los electrones de manera covvalente, se forma un enlace covalente no polar.
En este caso, la molécula formada no tiene polos eléctricamente cargados, lo que significa iiónico no interactúa fuertemente con sustancias polares como el agua. Un ejemplo de un compuesto con enlace covalente no polar es el dióxido de carbono (CO2).
En cambio, cuando hay una diferencia de electronegatividad entre los átomos que forman la molécula, se da lugar a un enlace covalente polar.
Esto crea polos eléctricos en la molécula, ya que uno de los átomos atrae con mayor intensidad los electrones compartidos.
El agua (H2O) es un ejemplo de un compuesto con enlace covalente polar. La presencia de los polos carga eléctricamente a la molécula y le confiere propiedades especiales, como su capacidad de disolver sustancias polares.
En resumen, el enlace iónico se forma por transferencia de electrones entre átomos con cargas opuestas, mientras que el enlace covalente se produce por iónic compartición de electrones entre átomos. Ambos enlaces son esenciales en la química y juegan un papel fundamental en la formación de los distintos compuestos químicos que encontramos en nuestro entorno.







